Como utilizar las reacciones químicas para producir electricidad
El uso de reacciones químicas para producir electricidad es ahora una prioridad para muchos investigadores. Ser capaz de utilizar adecuadamente las reacciones químicas como fuente de energía sería de gran ayuda a nuestros problemas de contaminación ambiental. En esta sección de la electroquímica, vamos a aprender como generar electricidad con reacciones químicas e incluso utilizar la electricidad para generar reacciones químicas. Con el fin de inducir un flujo de cargas eléctricas, se coloca una tira de metal (el electrodo) en una solución que contiene el mismo metal, que está en estado acuoso. La combinación de un electrodo y su solución se llama un medio celular. Dentro del medio celular, metales iones de la solución podría ganar electrones desde el electrodo y convertirse en átomos de metal, o los átomos de metal desde el electrodo podrían perder electrones y convertirse en iones de metales en la solución.
Celdas electroquímicas
Utilizamos dos medias celdas diferentes para medir la facilidad con que los electrones pueden fluir desde un electrodo a otro, y el dispositivo utilizado para la medición se llama voltímetro. El voltímetro mide el potencial de la celda, que se denota por Ecelda, (en unidades de voltios, 1V = 1J / C), que es la diferencia de potencial entre dos medias celdas. El puente salino permite que los iones fluyan de una media celda a otra, pero impide el flujo de soluciones.
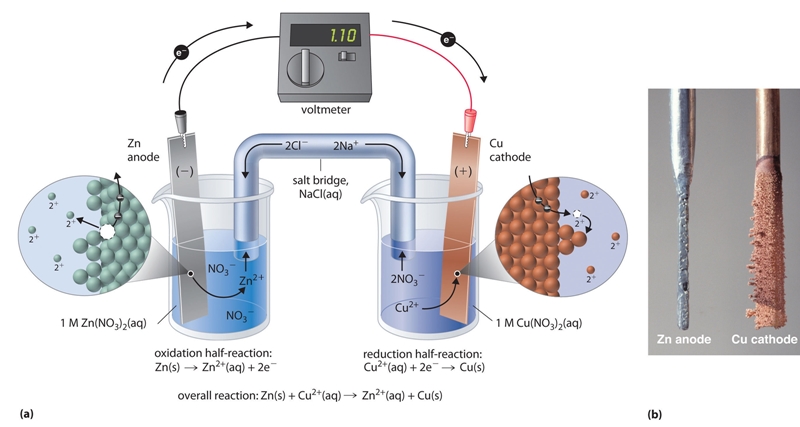
Como se indica en el diagrama, el ánodo es el electrodo cuando se produce la oxidación; Cu pierde dos electrones para formar Cu 2 . El cátodo es el electrodo donde se produce la reducción;
Tipos de celdas electroquímicas y sus caracteristicas principales
Una celda galvánica (celda voltaica) induce una reacción redox espontánea para crear un flujo de cargas eléctricas, o electricidad. Las baterías no recargables son ejemplos de celdas galvánicas.
- Una reacción es espontánea cuando el cambio en la energía de Gibb´s, ∆G es < 0.
- Los electrones fluyen desde el ánodo (negativo ya que los electrones se acumulan aquí) al cátodo (positivo ya que está ganando electrones).
Una celda electrolítica es un tipo de batería que requiere una fuente eléctrica exterior para conducir la reacción redox no espontánea. Las baterías recargables actúan como celdas electrolíticas cuando están siendo recargadas.
- Una reacción no es espontánea cuando ∆G es > 0.
- Debe suministrar electrones al cátodo para conducir la reducción, por lo que el cátodo es negativo.
- Debe eliminar los electrones desde el ánodo al conducir la oxidación, por lo que el ánodo es positivo.
Tanto las celdas galvánicas y celdas electrolíticas contienen:
- Dos electrodos: el ánodo y el cátodo (NOTA: cátodo no significa +, y el ánodo no significa -)
- Voltímetro: mide la corriente eléctrica. En las celdas galvánicas, esto demuestra la cantidad de corriente que se produce; en las celdas electrolíticas, esto demuestra la cantidad de corriente que está cargando el sistema.
- Electrólito
1. medio conductor
2. tiene contacto con electrodos
3. por lo general en solución acuosa de los compuestos iónicos - Puente salino
1. se une a las dos mitades de la celda electroquímica
2. llena con una solución salina o gel
3. mantiene la solución separada
4. Completa el circuito
