Conceptos fundamentales de la electroquímica y las celdas electroquímicas
¿Qué es electroquímica? La electroquímica es rama de que se ocupa de los cambios químicos producidos por la electricidad y la producción de electricidad por los cambios químicos.
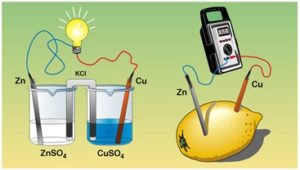
¿Qué en una celda electroquímica? Una celda electroquímica es un dispositivo que puede obtener energía eléctrica a partir de reacciones químicas (Celda Galvánica) o bien, de producir reacciones químicas a través de energía eléctrica (Celda Electrolítica).
¿Cuál es el uso de las celdas electroquimicas en la vida diaria? Un ejemplo común de una celda electroquímica en la vida cotidiana es la «pila» estándar de 1,5 voltios (Pila AA). En realidad, una «pila» es una celda galvánica simple, mientras tanto una batería consta de varias celdas conectadas en serie.
¿Cuál es la diferencia entre una pila y una batería? Una pila es una celda unitaria de energía que generalmente es de 1,5 voltios si se trata de una alcalina o de Zinc-Carbón. Si juntamos 6 de estas celdas en serie tenemos una batería equivalente a 9 voltios (6 x 1.5V = 9V).
¿Cuantos tipos de celdas electroquímicas existen? Hay dos tipos de celdas electroquímicas: celdas galvánicas, y celdas electrolíticas.
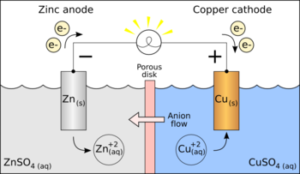
¿Cuál es la función de una celda galvánica? La celda galvánica o celda voltaica es una celda electroquímica que obtiene energía eléctrica a partir de reacciones químicas. Por lo general, consta de dos metales diferentes conectados por un puente salino, o medias celdas individuales separadas por una membrana porosa.
¿Cuál es la función de una celda electrolítica? Se llama celda electrolítica al dispositivo utilizado para la descomposición mediante corriente eléctrica de sustancias ionizadas lamadas electrolitos. Los electrolitos pueden ser ácidos, bases o sales.
¿Cuál es la función de un puente salino en una celda galvánica? La función del puente salino en una celda es la de aislar los contenidos de las dos partes de la celda mientras se mantiene el contacto eléctrico entre las dos. Los puentes salinos por lo general vienen en dos tipos: puentes salinos de tubo de vidrio y puentes salinos de papel filtro.
¿Para que sirve el puente salino en una celda galvánica? Para que los electrones puedan fluir una vez más, y las reacciones de reducción y oxidación (reacción redox) puedan continuar, cuando los electrones salen de una semi celda de la pila galvánica y fluyen a la otra. Si no se utilizara un puente salino se evitaría el flujo de más electrones y evitando el flujo de electrones.
¿En qué consiste el proceso de oxido reducción en los metales? Se denomina óxido-reducción, o reacción de reducción-oxidación o, simplemente, reacción redox, a toda reacción química en la que uno o más electrones se transfieran entre los reactivos, para provocar un cambio en sus estados de oxidación.
¿Qué factores se necesita para que una reacción redox suceda? Para que suceda una reacción de óxido-reducción, en un sistema debe haber un elemento que ceda electrones, y otro que los acepte.
¿Qué reacciones pueden suceder en una celda electroquímica? Una celda electroquímica puede o bien generar electricidad a partir de una reacción redox espontánea o consumir electricidad para conducir una reacción redox no espontánea.