Qué es una celda electroquímica
Una celda electroquímica es un dispositivo capaz de generar ya sea eléctrica la energía de las reacciones químicas o facilitar las reacciones químicas a través de la introducción de energía eléctrica. Un ejemplo común de una celda electroquímica es una celda estándar de 1.5 voltios (pila AA) hecha para el uso del consumidor. Este tipo de dispositivo se conoce como una sola celda galvánica. Una batería consta de dos o más celdas, conectadas, ya sea en paralelo o en patrón de series.
Funcionamiento de una celda electroquimica
Una celda electroquímica consiste en dos medias celdas. Cada celda media consiste en un electrodo y un electrolito. Las dos medias celdas pueden utilizar el mismo electrolito, o pueden utilizar diferentes electrolitos. Las reacciones químicas en la celda puede involucrar el electrolito, los electrodos, o una sustancia externa (como en celdas de combustible que pueden usar gas de hidrógeno como un reactivo). En una celda electroquímica completa, una especie de media-celda pierden electrones (oxidación) a su electrodo mientras que las especies de las otras media-celda ganan electrones (reducción) de su electrodo.
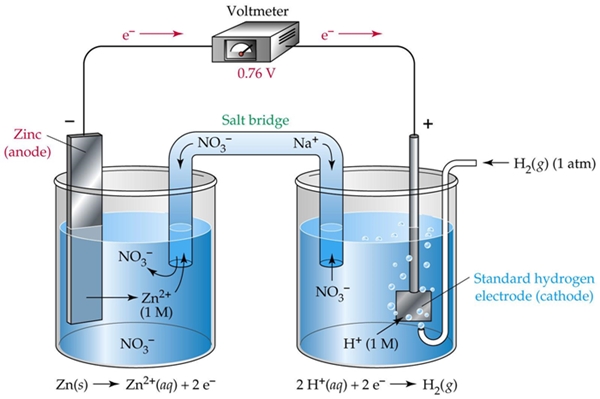
Para que sirve el puente salino en una celda galvanica:
Un puente salino (por ejemplo, papel de filtro empapado en KNO 3 o algún otro electrolito) se emplea a menudo para proporcionar un contacto iónico entre dos medias celdas con diferentes electrolitos, sin embargo, evitar la solución de las mezclas y evitar causar reacciones secundarias no deseadas. Una alternativa a un puente salino es para permitir el contacto directo (y mezclando) entre las dos medias celdas, por ejemplo, una simple electrólisis de agua.
Como los electrones fluyen de una media celda a otra a través de un circuito externo, se establece una diferencia de carga. Si no se proporciona ningún contacto iónico, esta diferencia de carga impediría rápidamente el flujo adicional de electrones. Un puente salino permite el flujo de iones negativos o positivos para mantener una distribución de carga de estado estacionario entre los vasos de oxidación y reducción, mientras se mantiene el contenido de otra manera separada.
Reacción de equilibrio
Cada media celda tiene una característica de voltaje. Varias alternativas de sustancias para cada media celda dan distintas diferencias de potencial. Cada reacción está experimentando una reacción de equilibrio entre diferentes estados de oxidación de los iones: Cuando se alcanza el equilibrio, la celda no puede proporcionar más voltaje. En la media celda está experimenta la oxidación, más cerca del equilibrio se encuentra el ion/átomo con el estado de oxidación más positivo el más potencial de esta reacción proporcionará. Del mismo modo, en la reacción de reducción, más cerca del equilibrio se encuentra al ion/átomo con el estado de oxidación más negativos cuanto mayor sea el potencial.
Potencial De Una Celda Electroquímica
Los potenciales de celda tienen un posible rango de aproximado de cero a 6 voltios. Las celdas utilizando electrolitos basados en agua se limitan generalmente a potenciales de celda menor que aproximadamente 2,5 voltios, debido a que el oxidante muy potente y agentes reductores que se requerirían para producir un potencial de celda más alta tienden a reaccionar con el agua. Potenciales de celda más altos son posibles con celdas utilizando otros disolventes en lugar de agua. Por ejemplo, las celdas de litio con una tensión de 3 voltios están comúnmente disponibles.
El potencial de la pila depende de la concentración de los reactivos, así como su tipo. Como se descarga la celda, la concentración de los reactivos disminuye, y el potencial de la pila también disminuye.
