¿Qué es una celda electrolítica y como esta formada?
Una celda electrolítica es una celda electroquímica que sufre un reacción redox cuando se aplica energía eléctrica. Con mayor frecuencia se utiliza para descomponer los compuestos químicos, en un proceso llamado electrólisis la palabra griega lisis significa romper. Cuando se añade la energía eléctrica al sistema, se aumenta la energía química. De manera similar a una pila galvánica, las celdas electrolíticas por lo general consisten en dos medias celdas.
Ejemplos importantes de electrólisis son la descomposición del agua en hidrógeno y oxígeno, y la bauxita en aluminio y otros productos químicos. Galvanización (por ejemplo, de cobre, plata, níquel o cromo) se realiza utilizando una celda electrolítica.

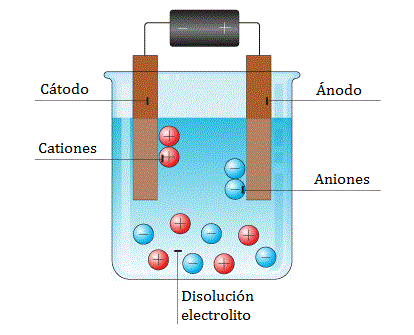
Una celda electrolítica tiene tres componentes: un electrolito y dos electrodos (un cátodo y un ánodo). El electrolito es por lo general una solución de agua u otros disolventes en el que se disuelven iones. Sales fundidas tales como cloruro de sodio también son electrolitos. Cuando accionamos un voltaje externo aplicándolo a los electrodos, los iones en el electrolito son atraídas a un electrodo con la carga opuesta, la carga de transferencia (también llamados corriente galvánica o redox) pueden tener lugar reacciones. Sólo con una potencial eléctrico externo (es decir, voltaje) con la polaridad correcta y suficiente magnitud puede una celda electrolítica descomponer un normalmente estable, o inerte compuesto químico en la solución. La energía eléctrica proporcionada puede producir una reacción química que no se produciría de forma espontánea de otra manera.
Diferencia entre celda electrolitica y celda galvanica
Por el contrario, una celda galvánica, convierte la energía química en energía eléctrica, mediante el uso de reacciones químicas espontáneas que tienen lugar en los electrodos. Cada celda galvánica tiene su propia característica de voltage (definida como la liberación de energía por transferencia de electrones desde un electrodo al otro). Una celda galvánica sencilla consistirá solamente en un electrolito y dos electrodos diferentes. (Las celdas galvánicas también se pueden hacer mediante la conexión de dos medias celdas, cada una con su propio electrodo y electrolito, por un «puente» de transporte de iones por lo general un puente salino; estas celdas son más complejas.) Los electrodos son típicamente dos metales, que, naturalmente, tienen diferentes potenciales de reacción en relación con el electrolito. Esto hace que los electrones de uno de los electrodos entren en la solución preferentemente en un electrodo, y otros electrones dejan la solución en el otro electrodo. Esto genera una corriente eléctrica a través del electrolito (donde los portadores de carga son las especies iónicas móviles), que conducen la corriente eléctrica a través de un cable que realizan una conexión exterior a cada uno de los electrodos. Tanto las celdas galvánicas y celdas electrolíticas pueden usar electrodos de diferentes metales, pero también pueden utilizar el mismo metal para los electrodos.
Una batería recargable, tal como una celda bateria AA NiMH o una sola celda de una batería de plomo-ácido, actúa como una celda galvánica cuando se descarga (convierte la energía química en energía eléctrica), y una celda electrolítica al ser cargada (convierte la energía eléctrica en energía química).

Batería AA NiMH
Una pila o batería de níquel-metal hidruro o de níquel-hidruro metálico (Ni-MH) es un tipo de batería recargable que utiliza un ánodo de oxihidróxido de níquel (NiOOH), como en la batería de níquel cadmio.

Batería de plomo y ácido
El acumulador o batería de plomo, también denominada batería de ácido-plomo es un tipo de batería (batería húmeda) muy común en vehículos convencionales, como batería de arranque.
